

Regelgeving: Veilige, effectieve en hoogwaardige geneesmiddelen op de markt
De ontwikkeling en het op de markt brengen van geneesmiddelen vormen een sterk gereguleerd proces, waarbij er voortdurende interactie plaatsvindt tussen het farmaceutische bedrijf, ook wel de "sponsor" genoemd, en de bevoegde gezondheidsautoriteiten. Aan de zijde van de sponsor is regulatory affairs verantwoordelijk voor het waarborgen van naleving van de wetten en richtlijnen met betrekking tot de veiligheid, werkzaamheid en kwaliteit van geneesmiddelen.
Deze blog behandelt de regelgevende processen in drie belangrijke fasen van de levenscyclus van een geneesmiddel, met de nadruk op de EU-regio. In een eerste fase van het ontwikkelingsproces van een geneesmiddel moet de sponsor een aanvraag indienen bij de bevoegde gezondheidsinstantie en goedkeuring verkrijgen voordat hij een klinische studie uitvoert. Zodra de klinische studies hebben aangetoond dat het nieuwe geneesmiddel veilig, doeltreffend en van hoge kwaliteit is voor de beoogde patiëntenpopulatie, kan het marketing authorization application (MAA) dossier worden ingediend bij de bevoegde gezondheidsinstantie. Bij een positieve beslissing kan het bedrijf het geneesmiddel op de markt brengen en beschikbaar maken voor patiënten. Ten slotte kunnen er tijdens de commerciële fase wijzigingen aan het product worden aangebracht. Indien deze een directe invloed hebben op de inhoud van het marketing authorisation (MA) dossier, moet een variatie procedure gevolgd worden.
1. Regelgeving bij klinische ontwikkeling
Het doel van klinische ontwikkeling is het onderzoeken van de veiligheid en werkzaamheid van een kandidaat-geneesmiddel bij de patiëntenpopulatie. Alvorens een clinical trial in een Europese lidstaat kan plaatsvinden, moet deze eerst worden goedgekeurd door de desbetreffende lidstaat. Daarom dient de sponsor een aanvraag voor een clinical trial in, waarbij zowel klinische als niet-klinische gegevens over het onderzochte product worden verstrekt. De aanvraag omvat een protocol met een beschrijving van de doelstellingen, de opzet en de methodologie van het onderzoek, details over de productie van het product (volgens de Good Manufacturing Practices (GMP)) en informatie over de werving van patiënten en geïnformeerde toestemming. Een evaluatie door de bevoegde instantie en een ethische evaluatie van het dossier door de ethische commissie worden uitgevoerd om te beoordelen of de proef kan worden goedgekeurd.
In 2022 werd een nieuwe verordening voor het uitvoeren van klinische proeven in de EU geïmplementeerd. Deze wordt de Clinical Trials Regulation (CTR) genoemd en vervangt de Clinical trials Directive. Het doel van deze nieuwe verordening is om de procedures voor de beoordeling van en het toezicht op klinische proeven te vereenvoudigen en te harmoniseren. Het stelt de organisatie in staat om een online aanvraag in te dienen bij 30 Europese lidstaten via één online platform dat bekend staat als het Clinical Trials Information System (CTIS), om zo toelating te krijgen in één of meer lidstaten. Er is momenteel een overgangsperiode voor sponsors om de nieuwe verordening te implementeren. Het implementeren van deze nieuwe verordening vormt een behoorlijke uitdaging voor de betrokken partijen.
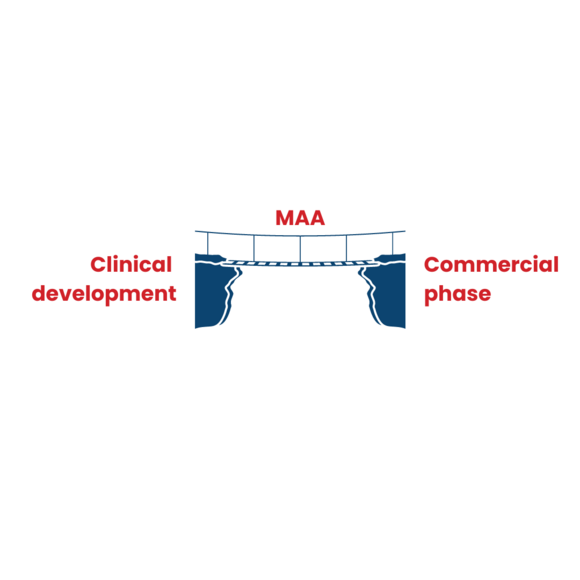
2. Marketing Authorisation: de brug tussen de klinische ontwikkelingsfase en de commerciële fase
Tijdens de klinische ontwikkeling wordt de toegang van patiënten tot een geneesmiddel streng gecontroleerd. Er is een marketing authorisation nodig voordat een geneesmiddel op de markt mag worden gedistribueerd en verkocht, door artsen mag worden voorgeschreven en door patiënten mag worden gebruikt. De marketing authorisation overbrugt daarom de kloof tussen de klinische ontwikkeling en de commerciële fase.
Als de klinische studies aantonen dat het product veilig en effectief is, kan de sponsor een marketing authorisation aanvragen bij de bevoegde gezondheidsautoriteit. Er zijn verschillende regelgevingsprocedures die verschillen in de toepasbaarheid van de resulterende vergunning. Enerzijds is er de gecentraliseerde procedure die resulteert in één enkele vergunning voor het in de handel brengen die geldig en bindend is in alle lidstaten. Anderzijds kan de nationale procedure worden toegepast om het product in één enkele lidstaat te registreren.
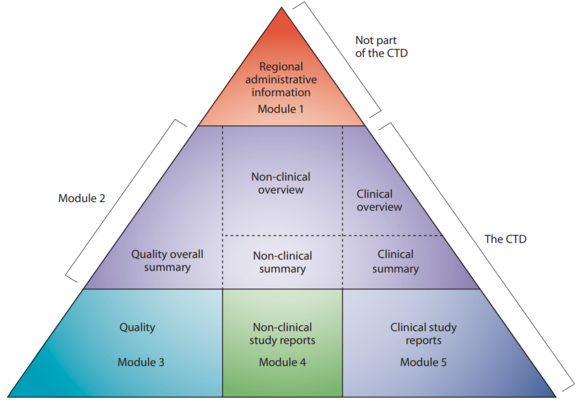
Het Common Technical Document (CTD) is de kern van de MAA. Hoewel het ook (gedeeltelijk) van toepassing is op aanvragen voor klinische studies, bevat het nu alle gegevens met betrekking tot de kwaliteit, veiligheid en werkzaamheid van het product dat op de markt zal worden gebracht. De structuur en het formaat van het CTD zijn vastgesteld binnen het ICH-kader.
Legende Structuur van een CTD
Module 1 Regiospecifiek en biedt administratieve gegevens
Module 2 Samenvattingen van Modules 3, 4 and 5
Module 3 Kwaliteitsaspecten
Module 4 Verslagen van de niet-klinische studies
Module 5 Verslagen van de klinische studies
3. Variaties in het registratiedossier beheren
Tijdens de levenscyclus kunnen updates van de marketing authorisation nodig zijn. Hieronder vallen bijvoorbeeld wijzigingen in het fabricageproces van het product (bijv. apparatuur, testmethoden, componenten, ...). Als onderdeel van het GMP change control proces moet worden beoordeeld of de geplande verandering rechtstreeks van invloed is op de informatie in het goedgekeurde registratiedossier. Als dat het geval is, moet een bijgewerkte versie van het registratiedossier worden ingediend bij de bevoegde instantie van de betrokken lidstaat. Een dergelijke wijziging in de voorwaarden van de marketing authorisation wordt een variatie genoemd.
Er zijn verschillende soorten variaties:
· Type IA variatie: Een variatie van type IA ("Do and Tell") heeft een minimale of geen invloed op de kwaliteit, veiligheid of werkzaamheid van het geneesmiddel. Kennisgeving aan de gezondheidsinstantie kan na implementatie plaatsvinden, aangezien er geen wetenschappelijke evaluatie vereist is.
Een voorbeeld van een Type IA variatie is een verstrenging van de specification limits van een afgewerkt product.
· Type IB variatie: Een Type IB variatie (“Tell, Wait and Do”) moet in eerste instantie worden gemeld aan de gezondheidsinstantie. Hierna volgt een wachttijd van 30 dagen voor evaluatie door de gezondheidsinstantie, zonder dat er een formele goedkeuring nodig is voor implementatie.
Een voorbeeld van een Type IB variatie is de toevoeging van een nieuwe fabrikant
· Type II variatie: Een wijziging van type II is een belangrijke verandering die een aanzienlijk effect kan hebben op de kwaliteit, veiligheid of werkzaamheid van het geneesmiddel en waarvoor mogelijk een strategische planning voor de implementatie nodig is. De ondersteunende documentatie moet uitgebreider zijn en de beoordeling door de gezondheidsautoriteit duurt langer (90 dagen).
Een voorbeeld van een Type II variatie is de toevoeging van een nieuwe therapeutische indicatie.
· Uitbereiding: Een uitbreiding betreft een aanzienlijke wijziging van de voorwaarden van de vergunning voor het in de handel brengen, en deze verandering kan niet worden afgehandeld via de reguliere wijzigingsprocedure. Daarom is het noodzakelijk om een aparte aanvraag voor uitbreiding in te dienen bij de gezondheidsautoriteit. Deze aanvraag kan leiden tot een uitbreiding van de bestaande vergunning voor het in de handel brengen of zelfs tot het verkrijgen van een geheel nieuwe vergunning voor het in de handel brengen.
Een voorbeeld van een uitbreiding is een verandering of toevoeging van een nieuwe toedieningsweg of een nieuwe sterkte/potentie.

Conclusie
Samenvattend hebben we de cruciale rol van regelgevende processen in diverse stadia van de geneesmiddelenontwikkeling benadrukt, gaande van de klinische fase tot de postcommerciële fase, inclusief variaties. Regulatory affairs vormt een essentieel onderdeel van de levenscyclus van geneesmiddelen en waarborgt dat alleen veilige, effectieve en hoogwaardige geneesmiddelen op de markt worden gebracht en beschikbaar zijn voor het grote publiek.

