

De drie pijlers van procesvalidatie: een inzichtelijke verkenning

- Aline Acke
Om aan de behoeften van patiënten te voldoen, verrichten wetenschappelijke laboratoria intensief onderzoek naar de ontwikkeling van nieuwe en verbeterde geneesmiddelen. Maar wat gebeurt er nadat een nieuw product is ontdekt? Kan het zomaar op de markt komen, en is het wel betrouwbaar? Het spookbeeld van Softenon-baby's komt misschien op wanneer we denken aan nieuw ontwikkelde medicijnen.
Gelukkig zijn er sinds de jaren ‘60 veel strengere eisen en streven farmaceutische bedrijven ernaar kwalitatieve medicatie op de markt te brengen. Belangrijk hierbij is het volledig in kaart brengen, evalueren en continu onder controle houden van het productieproces, ook wel bekend als procesvalidatie, een essentieel aspect binnen de farmaceutische sector.
In deze informatieve blog duiken we dieper in de wereld van procesvalidatie, een cruciaal onderdeel binnen de farmaceutische industrie.
Inleiding
De validatie van productieprocessen is van groot belang om zowel de kwaliteit als de effectiviteit van de eindproducten te waarborgen en te bewijzen dat het proces volledig onder controle is.
Aangezien procesvalidatie het hele proces en bedrijf bestrijkt, is een interdisciplinaire aanpak essentieel. Door teams zoals engineering, microbiologie, statistiek, manufacturing, quality assurance (QA), enzovoort samen te laten werken, kan informatie over de levenscyclus van een product of proces vanuit verschillende perspectieven worden bestudeerd en geïnterpreteerd.
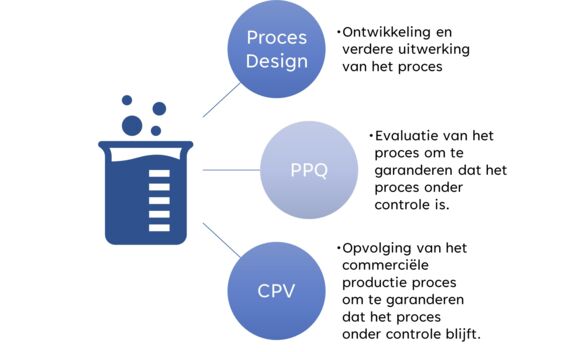
Procesvalidatie en al zijn facetten die hierbij komen kijken kunnen dan ook worden onderverdeeld in drie grote pijlers: Proces Design, Process Performance Qualification en Continued process verification. Elk van deze pijlers zal ook nog eens uit verschillende stappen bestaan, waarbij als finale output een correct maar vooral veilig product afgeleverd zal worden.
Procesvalidatie omvat drie grote pijlers:
Pijler 1: Procesdesign - bouwen aan kennis
We starten onze weg naar een commercieel product door proceskennis op te bouwen via wetenschappelijke experimenten, meestal uitgevoerd op kleinere schaal in laboratoria. Samen met eerder verzamelde informatie tijdens de productontwikkeling dienen deze experimenten om grootschalige productie te realiseren en inzicht te krijgen in de parameters die zowel de kwaliteit van het product als de output van het proces beïnvloeden.
Na het vergaren van proceskennis wordt een strategie ontwikkeld om het proces te beheersen. Controles omvatten de analyse van (tussen)product stalen en het monitoren van gebruikte apparatuur met behulp van alarmsystemen tijdens kritieke procespunten.
Risk assessments worden uitgevoerd om stappen met meer risico's te identificeren, waardoor een nauwere opvolging nodig is. Hierdoor worden alle procesparameters ingedeeld van uiterst kritisch tot minder kritisch, en de evaluatiestrengheid varieert afhankelijk van de afwijking van een bepaalde parameter van zijn vastgestelde waarde.
Risk assessments worden uitgevoerd om stappen met meer risico's te identificeren, waardoor een nauwere opvolging nodig is. Hierdoor worden alle procesparameters ingedeeld van uiterst kritisch tot minder kritisch, en de evaluatiestrengheid varieert afhankelijk van de afwijking van een bepaalde parameter van zijn vastgestelde waarde.
Pijler 2: Process Performance Qualification (PPQ) - Streven naar perfectie
Na het vergaren van voldoende proceskennis en het beoordelen van de kritieke aspecten, gaan we over naar de kwalificatie van het proces. Vanaf dit punt is het essentieel om te voldoen aan de Good Manufacturing Practices (GMP), wat eerder niet verplicht was volgens overheidsinstanties zoals de FDA en EMA.
De eerste stap in deze fase is de kwalificatie van de gebruikte apparatuur, zoals (bio)reactoren, vriezers en ruimtes. Na het succesvol doorlopen van deze faciliteitskwalificatie kan de effectieve proceskwalificatie (PPQ) van start gaan.
Tijdens PPQ worden alle parameters die eerder als kritiek zijn aangemerkt nauwlettend gevolgd. In vergelijking met routineproductie worden er vaak meer stalen genomen en extra tests uitgevoerd om met hoge zekerheid te bevestigen dat het proces onder controle is. Het PPQ-protocol moet bevatten:
- Een strategie met alle criteria en procesperformanceparameters*, inclusief een statistische beschrijving van de data-analyse om variaties te trenden, en procedures voor omgang met deviaties en niet-conforme data.
- Specificaties voor de te verzamelen data.
- Testen die moeten worden uitgevoerd, met criteria voor het beschouwen van een test als 'geslaagd'.
- Een samplingplan dat alle stalen bevat die tijdens elke processtap moeten worden genomen.
- Validatiestatus van de analytische methoden die worden gebruikt op (tussentijdse) producten.
- Review en goedkeuring van alle betrokken departementen en quality (QA).
Aan de hand van dit protocol worden vervolgens de PPQ-runs uitgevoerd en vastgelegd in een rapport met alle verkregen data en informatie. Vaak wordt PPQ als succesvol beschouwd wanneer drie opeenvolgende runs met succes zijn afgerond.
*Procesperformanceparameter is een metriek die wordt gebruikt om de prestatie van een proces te meten. Je wilt het liefst stuurinformatie hebben die je kan gebruiken om het proces de juiste richting in te sturen.
Pijler 3: Continued process verification (CPV) - Het proces blijft onder de loep
Met een succesvolle afronding van PPQ kan het product eindelijk commercieel worden geproduceerd en op de markt worden gebracht. Echter, de procesopvolging stopt hier niet. Tijdens elke productierun worden nog steeds stalen genomen en geanalyseerd om mogelijke variaties of ongewenste trends in het proces snel op te sporen en te corrigeren.
Door middel van statistische trending wordt zowel de kwaliteit van het proces als de prestaties nauwlettend in de gaten gehouden, in vergelijking met de eerder verkregen procesparameters die invloed hebben op de procescontrole en dus ook op het eindproduct.
Deze figuur biedt een samenvatting van de drie pijlers:
Conclusie: Garantie voor kwaliteit en veiligheid:
De drie pijlers van procesvalidatie zorgen ervoor dat farmaceutische bedrijven consistent producten van de hoogste kwaliteit kunnen leveren. Hierdoor wordt niet alleen gegarandeerd dat geneesmiddelen effectief zijn, maar bovenal veilig voor gebruik.
Wist je dat...
Ons MoVE team elke dag klaar staat om bij te dragen aan de tweede en derde pijler? Onze collega's hebben expertise binnen staalnamen en testing, maar ook binnen kwalificatie om ervoor te zorgen dat jouw apparatuur of ruimte (cleanroom, magazijn,...) conform de wettelijk eisen zijn met oog op kwaliteit en veiligheid.
Kan jij daarbij nog ondersteuning gebruiken? Contacteer ons dan via move@advipro.com, Nathan, associate business manager van MoVE, bekijkt samen met jou graag de mogelijkheden.
Wil jij bijdragen aan veilige medicatie?
Werd je getriggerd door het lezen van deze blog en sta jij nu zelf ook te springen om een steentje bij te dragen binnen de farmaceutische wereld? Neem dan zeker een kijkje bij onze vacatures via onderstaande knop, en wie weet werk jij binnenkort ook mee aan het in stand houden van veilige medicatie binnen onze maatschappij!

